Tính phần trăm là gì? Hướng dẫn tính phần trăm (%) khối lượng của các nguyên tố hóa học đơn giản, dễ hiểu nhất?
Tính phần trăm là gì?
Trong lĩnh vực toán học, phần trăm là một tỷ lệ được biểu diễn dưới dạng phân số với mẫu số cố định là 100. Thông thường, phần trăm được trình bày dưới dạng số nguyên hoặc số thập phân, đi kèm với ký hiệu % để dễ nhận diện.
Ví dụ như 30%, 60%, 10%,... Phép tính phần trăm có thể thay đổi tùy thuộc vào ngữ cảnh sử dụng, chẳng hạn như: tính lãi suất; tính thuế thu nhập cá nhân; áp dụng khuyến mãi...
Nói chung, phần trăm được dùng để biểu thị tỷ lệ hoặc so sánh mức độ của một giá trị so với một giá trị khác. Ngoài ra, phần trăm còn giúp xác định số tiền cần chi trả trong các phép tính tài chính.
*Lưu ý: Thông tin trên chỉ mang tính chất tham khảo

Tính phần trăm là gì? Hướng dẫn tính phần trăm (%) khối lượng của các nguyên tố hóa học đơn giản, dễ hiểu nhất? (Hình từ Internet)
Hướng dẫn tính phần trăm (%) khối lượng của các nguyên tố hóa học đơn giản, dễ hiểu nhất?
Tham khảo, bảng nguyên tố hóa học đang được sử dụng với cấu trúc đầy đủ cùng cách đọc theo chương trình mới như sau:
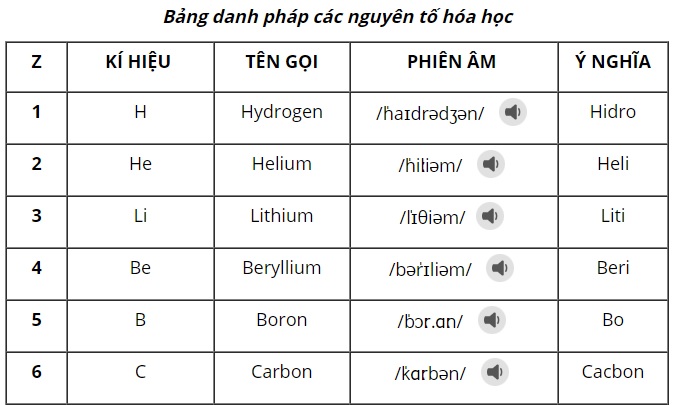
>> Tải về Chi tiết cách đọc bảng nguyên tố theo chương trình mới
Hướng dẫn tính phần trăm (%) khối lượng của các nguyên tố hóa học như sau:
Công thức tính phần trăm khối lượng các nguyên tố có trong hợp chất:
Phần trăm khối lượng (M)= (khối lượng mol nguyên tố/khối lượng phân tử của hợp chất) x 100.
Ví dụ tính phần trăm khối lượng của hợp chất sau: FeCl3. Biết rằng, nguyên tử khối của Fe= 56; Cl =35,5.
Như vậy % khối lượng nguyên tố Fe, Cl được tính như sau:
Tổng khối lượng FeCl3= 56 + 35.5 x3 = 162.5 (trong đó: 1 mol Fe có chưa 3 mol Cl)
=> %mFe = (56/162.5) x 100 = 34.46% ;
%mCl = (35.5 x3) /162.5 x 100 = 65.5%
Lưu ý:
Tổng hợp trọn bộ kiến thức môn hóa học lớp 10, 11, 12 cần nắm?
Trọn bộ nội dung môn hóa học lớp 10, 11, 12 cần nắm được quy định tại Phụ lục ban hành kèm theo Thông tư 32/2018/TT-BGDĐT được sửa đổi bởi Thông tư 13/2022/TT-BGDĐT như sau:
LỚP 10
Nội dung | Yêu cầu cần đạt |
Nhập môn hoá học | - Nêu được đối tượng nghiên cứu của hoá học. - Trình bày được phương pháp học tập và nghiên cứu hoá học. - Nêu được vai trò của hoá học đối với đời sống, sản xuất,... |
CẤU TẠO NGUYÊN TỬ | |
Các thành phần của nguyên tử | - Trình bày được thành phần của nguyên tử (nguyên tử vô cùng nhỏ; nguyên tử gồm 2 phần: hạt nhân và lớp vỏ nguyên tử; hạt nhân tạo nên bởi các hạt proton (p), neutron (n); Lớp vỏ tạo nên bởi các electron (e); điện tích, khối lượng mỗi loại hạt). - So sánh được khối lượng của electron với proton và neutron, kích thước của hạt nhân với kích thước nguyên tử. |
Nguyên tố hoá học | - Trình bày được khái niệm về nguyên tố hoá học, số hiệu nguyên tử và kí hiệu nguyên tử. - Phát biểu được khái niệm đồng vị, nguyên tử khối. - Tính được nguyên tử khối trung bình (theo amu) dựa vào khối lượng nguyên tử và phần trăm số nguyên tử của các đồng vị theo phổ khối lượng được cung cấp. |
Cấu trúc lớp vỏ electron nguyên tử | - Trình bày và so sánh được mô hình của Rutherford - Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử. - Nêu được khái niệm về orbital nguyên tử (AO), mô tả được hình dạng của AO (s, p), số lượng electron trong 1 AO. - Trình bày được khái niệm lớp, phân lớp electron và mối quan hệ về số lượng phân lớp trong một lớp. Liên hệ được về số lượng AO trong một phân lớp, trong một lớp. - Viết được cấu hình electron nguyên tử theo lớp, phân lớp electron và theo ô orbital khi biết số hiệu nguyên tử Z của 20 nguyên tố đầu tiên trong bảng tuần hoàn. - Dựa vào đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử dự đoán được tính chất hoá học cơ bản (kim loại hay phi kim) của nguyên tố tương ứng. |
....
>> Tải về Xem chi tiết trọn bộ chương trình lớp 10 môn hóa học cần nắm vững.
LỚP 11
Nội dung | Yêu cầu cần đạt |
CÂN BẰNG HOÁ HỌC | |
Khái niệm về cân bằng hoá học | - Trình bày được khái niệm phản ứng thuận nghịch và trạng thái cân bằng của một phản ứng thuận nghịch. - Viết được biểu thức hằng số cân bằng (KC) của một phản ứng thuận nghịch. - Thực hiện được thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng: (1) Phản ứng: 2NO2 N2O4 (2) Phản ứng thuỷ phân sodium acetate. - Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hoá học. |
Cân bằng trong dung dịch nước | - Nêu được khái niệm sự điện li, chất điện li, chất không điện li. - Trình bày được thuyết Brønsted - Lowry về acid - base. - Nêu được khái niệm và ý nghĩa của pH trong thực tiễn (liên hệ giá trị pH ở các bộ phận trong cơ thể với sức khoẻ con người, pH của đất, nước tới sự phát triển của động thực vật,...). - Viết được biểu thức tính pH (pH = -lg[H+] hoặc [H+] = 10-pH) và biết cách sử dụng các chất chỉ thị để xác định pH (môi trường acid, base, trung tính) bằng các chất chỉ thị phổ biến như giấy chỉ thị màu, quỳ tím, phenolphthalein,... - Nêu được nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ. - Thực hiện được thí nghiệm chuẩn độ acid - base: Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid). - Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và . |
...
>> Tải về Xem chi tiết trọn bộ chương trình lớp 11 môn hóa học cần nắm vững.
LỚP 12
Nội dung | Yêu cầu cần đạt |
ESTER - LIPID | |
- Nêu được khái niệm về lipid, chất béo, acid béo, đặc điểm cấu tạo phân tử ester. - Viết được công thức cấu tạo và gọi được tên một số ester đơn giản (số nguyên tử C trong phân tử ≤ 5) và thường gặp. - Trình bày được phương pháp điều chế ester và ứng dụng của một số ester. - Trình bày được đặc điểm về tính chất vật lí và tính chất hoá học cơ bản của ester (phản ứng thuỷ phân) và của chất béo (phản ứng hydrogen hoá chất béo lỏng, phản ứng oxi hoá chất béo bởi oxygen không khí). - Trình bày được ứng dụng của chất béo và acid béo (omega-3 và omega-6). - Nêu được khái niệm, đặc điểm về cấu tạo và tính chất chất giặt rửa của xà phòng và chất giặt rửa tự nhiên, tổng hợp. - Trình bày được một số phương pháp sản xuất xà phòng, phương pháp chủ yếu sản xuất chất giặt rửa tổng hợp. - Thực hiện được (hoặc quan sát video) thí nghiệm về phản ứng xà phòng hoá chất béo. - Trình bày được cách sử dụng hợp lí, an toàn xà phòng và chất giặt rửa tổng hợp trong đời sống. | |
CARBOHYDRATE | |
- Nêu được khái niệm, cách phân loại carbohydrate, trạng thái tự nhiên của glucose, fructose, saccharose, maltose, tinh bột và cellulose. - Viết được công thức cấu tạo dạng mạch hở, dạng mạch vòng và gọi được tên của một số carbohydrate: glucose và fructose; saccharose, maltose; tinh bột và cellulose. - Trình bày được tính chất hoá học cơ bản của glucose và fructose (phản ứng với copper(II) hydroxide, nước bromine, thuốc thử Tollens, phản ứng lên men của glucose, phản ứng riêng của nhóm -OH hemiacetal khi glucose ở dạng mạch vòng). - Trình bày được tính chất hoá học cơ bản của saccharose (phản ứng với copper(II) hydroxide, phản ứng thuỷ phân). - Trình bày được tính chất hoá học cơ bản của tinh bột (phản ứng thuỷ phân, phản ứng với iodine); của cellulose (phản ứng thuỷ phân, phản ứng với nitric acid và với nước Schweizer (Svayde). - Thực hiện được (hoặc quan sát video) thí nghiệm về phản ứng của glucose (với copper(II) hydroxide, nước bromine, thuốc thử Tollens); của saccharose (phản ứng với copper(II) hydroxide); của tinh bột (phản ứng thuỷ phân, phản ứng của hồ tinh bột với iodine); của cellulose (phản ứng thuỷ phân, phản ứng với nitric acid và tan trong nước Schweizer). Mô tả các hiện tượng thí nghiệm và giải thích được tính chất hoá học của glucose, fructose, saccharose, tinh bột và cellulose. - Trình bày được sự chuyển hoá tinh bột trong cơ thể, sự tạo thành tinh bột trong cây xanh và ứng dụng của một số carbohydrate. |
>> Tải về Xem chi tiết trọn bộ chương trình lớp 12 môn hóa học cần nắm vững.
Tiêu chuẩn chung để trở thành giáo viên trung học phổ thông được quy định như thế nào?
Tiêu chuẩn để trở thành giáo viên được quy định tại Điều 67 Luật Giáo dục 2019 như sau:
Tiêu chuẩn của nhà giáo
Nhà giáo phải đáp ứng các tiêu chuẩn sau đây:
1. Có phẩm chất, tư tưởng, đạo đức tốt;
2. Đáp ứng chuẩn nghề nghiệp theo vị trí việc làm;
3. Có kỹ năng cập nhật, nâng cao năng lực chuyên môn, nghiệp vụ;
4. Bảo đảm sức khỏe theo yêu cầu nghề nghiệp.
Theo đó, để trở thành giáo viên, cá nhân cần phải đáp ứng các tiêu chuẩn sau đây:
- Có phẩm chất, tư tưởng, đạo đức tốt;
- Đáp ứng chuẩn nghề nghiệp theo vị trí việc làm;
- Có kỹ năng cập nhật, nâng cao năng lực chuyên môn, nghiệp vụ;
- Bảo đảm sức khỏe theo yêu cầu nghề nghiệp.
Lưu ý:
Quyền và nhiệm vụ của giáo viên được quy định tại Điều 69 Luật Giáo dục 2019 và Điều 70 Luật Giáo dục 2019 như sau:
(1) Nhiệm vụ của nhà giáo
- Giảng dạy, giáo dục theo mục tiêu, nguyên lý giáo dục, thực hiện đầy đủ và có chất lượng chương trình giáo dục.
- Gương mẫu thực hiện nghĩa vụ công dân, điều lệ nhà trường, quy tắc ứng xử của nhà giáo.
- Giữ gìn phẩm chất, uy tín, danh dự của nhà giáo; tôn trọng, đối xử công bằng với người học; bảo vệ các quyền, lợi ích chính đáng của người học.
- Học tập, rèn luyện để nâng cao phẩm chất đạo đức, trình độ chính trị, chuyên môn, nghiệp vụ, đổi mới phương pháp giảng dạy, nêu gương tốt cho người học.
(2) Quyền của nhà giáo
- Được giảng dạy theo chuyên môn đào tạo.
- Được đào tạo, bồi dưỡng nâng cao trình độ chính trị, chuyên môn, nghiệp vụ.
- Được hợp đồng thỉnh giảng, nghiên cứu khoa học tại cơ sở giáo dục khác hoặc cơ sở nghiên cứu khoa học.
- Được tôn trọng, bảo vệ nhân phẩm, danh dự và thân thể.
- Được nghỉ hè theo quy định của Chính phủ và các ngày nghỉ khác theo quy định của pháp luật.
Ứng xử của giáo viên được quy định tại Điều 6 Thông tư 06/2019/TT-BGDĐT như sau:
- Ứng xử với người học: Ngôn ngữ chuẩn mực, dễ hiểu, khen hoặc phê bình phù hợp với đối tượng và hoàn cảnh; mẫu mực, bao dung, trách nhiệm, yêu thương; tôn trọng sự khác biệt, đối xử công bằng, tư vấn, lắng nghe và động viên, khích lệ người học; tích cực phòng, chống bạo lực học đường, xây dựng môi trường giáo dục an toàn, lành mạnh, thân thiện. Không xúc phạm, gây tổn thương, vụ lợi; không trù dập, định kiến, bạo hành, xâm hại; không thờ ơ, né tránh hoặc che giấu các hành vi vi phạm của người học.
- Ứng xử với cán bộ quản lý: Ngôn ngữ tôn trọng, trung thực, cầu thị, tham mưu tích cực và thể hiện rõ chính kiến; phục tùng sự chỉ đạo, điều hành và phân công của lãnh đạo theo quy định. Không xúc phạm, gây mất đoàn kết; không thờ ơ, né tránh hoặc che giấu các hành vi sai phạm của cán bộ quản lý.
- Ứng xử với đồng nghiệp và nhân viên: Ngôn ngữ đúng mực, trung thực, thân thiện, cầu thị, chia sẻ, hỗ trợ; tôn trọng sự khác biệt; bảo vệ uy tín, danh dự và nhân phẩm của đồng nghiệp, nhân viên. Không xúc phạm, vô cảm, gây mất đoàn kết.
- Ứng xử với cha mẹ người học: Ngôn ngữ đúng mực, trung thực, tôn trọng, thân thiện, hợp tác, chia sẻ. Không xúc phạm, áp đặt, vụ lợi.
- Ứng xử với khách đến cơ sở giáo dục: Ngôn ngữ đúng mực, tôn trọng. Không xúc phạm, gây khó khăn, phiền hà.
>> Xem thêm:
Tải về Dự thảo Luật Nhà giáo
Tải về Bảng lương giáo viên 2024 các cấp
Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.









